 Por Horacio de la Iglesia (Department of Biology, University of Washington)
Por Horacio de la Iglesia (Department of Biology, University of Washington)
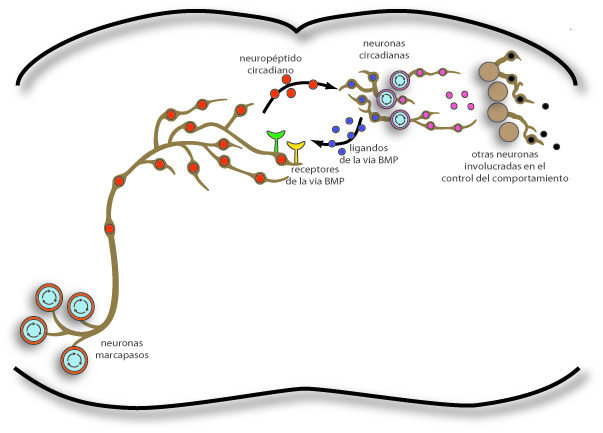
En nuestros primeros cursos de neurociencias aprendimos (y luego enseñamos) a ponderar a la sinapsis química como la estructura y el fenómeno más importante del sistema nervioso. Después de todo, de que nos servirían nuestras 1012 neuronas si no tuviéramos el privilegio de conectarlas y desconectarlas unas con otras. Cuando abordamos la sinapsis no podemos evitar el pensamiento lineal que tanto caracteriza a los científicos, A (léase neurona presináptica) causa un efecto en B (neurona postsináptica) y luego lo más importante debe ser lo que B causa en C (otra neurona río abajo). En la fascinación por este impecable proceso por el que las neuronas se comunican unas con otras, tendemos a olvidar la importancia de que la neurona B se comunique, retrógradamente, con la neurona A para que el circuito funcione normalmente. El grupo de la Dra. M. Fernanda Ceriani, de la Fundación Instituto Leloir (http://www.leloir.org.ar/ceriani-en/), nos refresca la memoria en un artículo publicado en la revista PLOS Biology (Beckwith et al., 2013) en diciembre de 2013, donde demuestra la importancia de la comunicación retrógrada mediante la vía de la proteína morfogenética del hueso (BMP, del inglés bone morphogenetic protein) en el circuito neuronal que constituye el reloj circadiano de Drosophila (http://www.ncbi.nlm.nih.gov/pubmed/24339749).
Beckwith y colaboradores utilizaron una estrategia de genética directa que aprovecha las maravillas de Drosophila, en donde uno puede alterar la expresión de genes al azar pero no en toda la mosca (ni siquiera en todo el cerebro), sino específicamente en un grupo de 4 neuronas, las neuronas laterales ventrales pequeñas (sLNvs), que son indispensables para el funcionamiento normal del reloj circadiano de la mosca. La estrategia de mutagénesis en Drosophila ha constituido la vía más fructífera en determinar las bases genéticas del comportamiento. Es más, la primera mutación puntual que modificó el comportamiento en un animal fue nada más y nada menos que una ¨mutación¨ que alteró el reloj circadiano de Drosophila. El gen mutado resultó ser un componente esencial del mecanismo intracelular que constituye el reloj circadiano. El primer resultado del grupo de Ceriani nos recuerda estos experimentos clásicos, en donde los mutantes muestran un ritmo circadiano de actividad locomotora con un período más largo (de ~25.5 horas en lugar del período salvaje de ~24 horas). Quizá lo más inesperado es que al mapear el gen alterado, Beckwith y colegas descubrieron que este enlentecimiento del reloj circadiano no se debe a la modificación de alguno de los genes esenciales para mantener el ciclo de transcripción y traducción que constituye el reloj, sino a la del gen schnurri, cuyo producto está involucrado en la represión de genes específicos cuando se activa la vía de BMP. En una serie de experimentos que combinan sofisticación y elegancia, los investigadores demuestran que la alteración induce la sobreexpresión de una variante del gen, y que la sobre-activación de la vía de BMP mediante otras manipulaciones genéticas en las sLNvs emula el alargamiento del período circadiano. El bloqueo de la vía, en cambio, induce una ruptura más drástica del reloj, y las moscas pierden su ritmicidad circadiana. En otros experimentos, los autores disminuyen los niveles de distintos ligandos de la vía de BMP en distintas neuronas de la red circadiana y confirman la importancia de la vía en la integridad del reloj. En un experimento fundamental, el grupo de investigadores demuestra que el efecto de interferir con la vía de BMP no se debe al rol que la proteína pueda tener en el desarrollo del circuito neuronal, sino al rol específico de esta vía en la comunicación neuronal adulta. Finalmente, y para que no quepan dudas de cómo la vía de BMP interactúa con el reloj circadiano propiamente dicho, los investigadores demuestran que los efectores de la vía tienen la capacidad de inhibir la expresión de uno de los factores de transcripción esenciales para que el reloj funcione, el gen clock, y en colaboración con el grupo de A. Nadra (FCEN, UBA) identificaron en su promotor sitios de reconocimiento para los activadores de la vía de BMP.
El artículo del grupo de Ceriani tiene implicancias fundamentales para el campo de relojes circadianos, así como para el campo de circuitos neuronales en general. Desde el descubrimiento de que el mecanismo de generación de ritmos circadianos se basa en procesos intracelulares, principalmente ciclos de retroalimentación negativa que involucran transcripción y traducción, poco se ha avanzado en la importancia de las propiedades intercelulares del circuito neuronal del reloj. El laboratorio de Ceriani ha dedicado varios años al tema y descubierto propiedades del circuito esenciales para el tiempo biológico circadiano. En el artículo presente, los investigadores revelan una nueva propiedad fundamental del circuito, y una que nadie hubiese esperado. Quizá más importante aun son las implicancias del estudio en las neurociencias en general. La vía de BMP es conocida por su rol esencial en el desarrollo, no sólo de hueso, sino de muchos otros tejidos incluido el nervioso. De hecho, su importancia crítica impide estudios de genética reversa o directa clásicos que involucren esta vía debido a que su falta durante el desarrollo es letal. La capacidad del grupo de la Fundación Instituto Leloir de restringir las alteraciones a un grupo específico de neuronas, y de hacerlo específicamente en el adulto, permitió demostrar el rol específico de esta vía en la comunicación neuronal adulta. Cabe entonces preguntar, ¿cuántos otros circuitos neuronales involucrarán la vía de señalización retrógrada de BMP para funcionar normalmente? Una pregunta a la que, luego de este trabajo, seguramente se abocarán varios laboratorios en el mundo.
Beckwith, E.J., Gorostiza, E.A., Berni, J., Rezaval, C., Perez-Santangelo, A., Nadra, A.D. & Ceriani, M.F. (2013) Circadian period integrates network information through activation of the BMP signaling pathway. PLoS Biol., 11, e1001733.
