Desde hace siglos conocemos una infinidad de sustancias que son capaces de modificar nuestra percepción del mundo, ya que su accionar está dirigido a nuestro cerebro. Hoy sabemos que un gran número de estas sustancias pueden afectar nuestras neuronas, al punto de generar lo que conocemos como adicción a las drogas.
Por lo tanto, es muy importante conocer cómo estas drogas de adicción afectan a nuestro sistema nervioso, sobre todo cómo lo hacen a nivel celular y molecular. En el laboratorio del Dr. Peter Kalivas (Medical University of South Carolina) llevan estudiando desde hace décadas los mecanismos por los cuales este tipo de drogas, como la cocaína, el cannabis, la heroína o la nicotina, genera lo que se conoce como recaída en las drogas, y sobre todo cómo el abuso de estas sustancias produce cambios duraderos en la función cerebral, cambios que finalmente van a verse reflejados en una vulnerabilidad a la recaída, lo que define per se a la adicción.
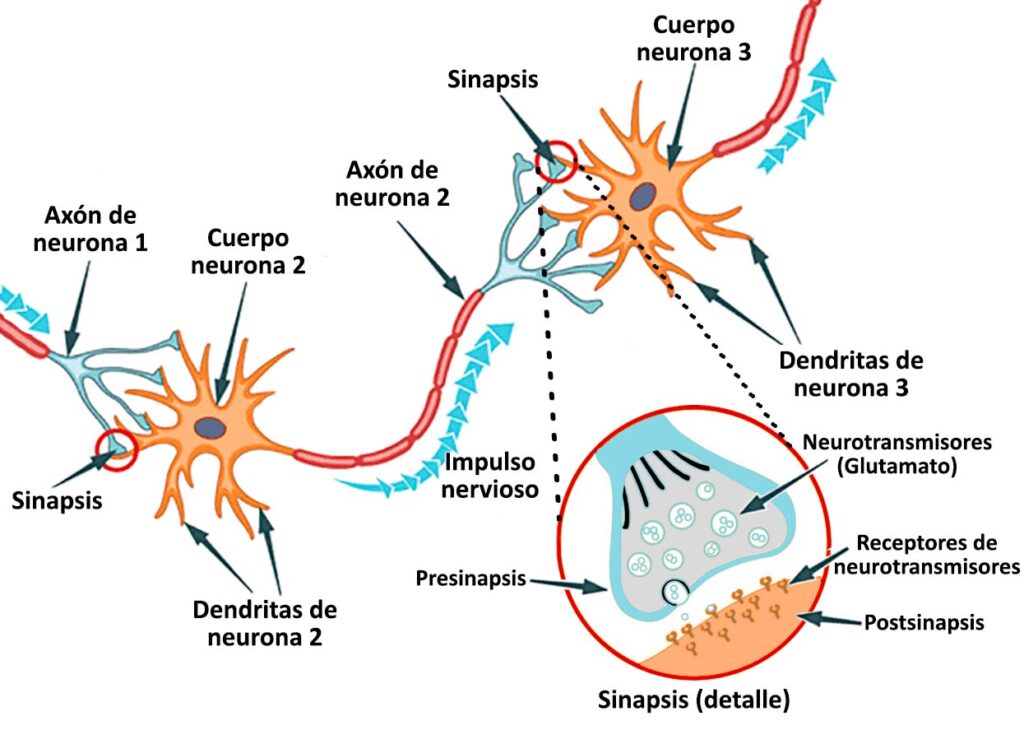
Lo primero que hay que tener en cuenta es que nuestro cerebro es plástico. No, no está hecho de plástico, sino que nos referimos a la etimología de esa palabra, que en griego quiere decir “modelar”. Es decir, el cerebro puede ser modelado. ¿Y esto qué quiere decir? Básicamente que no posee una estructura fija, sino que va cambiando a medida que aprendemos y memorizamos, entre otras cosas. Esto se logra gracias a lo que se conoce justamente como plasticidad sináptica, que es una característica inherente de las neuronas. Estas células típicas de nuestro sistema nervioso (y el de muchos animales) son capaces de conectarse entre sí a través de largos “cables” conocidos como axones, que pueden a su vez interactuar con extensiones, llamadas dendritas, de otras neuronas. Estas conexiones entre axones y dendritas se conocen como sinapsis (de allí lo de plasticidad sináptica), las cuales son centrales para establecer, entre otras cosas, el aprendizaje y las nuevas memorias. Una sola neurona puede recibir conexiones de muchas otras, y todas estas pueden crecer o disminuir en número, hacerse más fuertes o débiles, permitiendo que, por ejemplo, una memoria se establezca o desaparezca para siempre. Eso es lo que permite que nuestro cerebro sea considerado “plástico”.
Esta plasticidad, como se imaginarán, puede ser influenciada por muchas cosas, y entre ellas encontramos a las drogas de adicción, que pueden afectar la transmisión del impulso nervioso de las neuronas entre axones y dendritas, y por ende perturbar la plasticidad. Pero como ya vimos, la plasticidad de nuestro cerebro le permite adaptarse a nuevas situaciones (como por ejemplo al uso continuo de una droga), lo que termina causando un estado que a simple vista pareciera estable, pero que en realidad es una bomba a punto de estallar. ¿Por qué? Cuando una persona deja de consumir una droga de adicción luego de un uso continuo, puede producirse lo que se conoce como período de abstinencia, donde la necesidad de consumir esa droga pareciera ir desvaneciéndose a lo largo del tiempo. Pero la aparición de alguna señal asociada a la droga en cuestión (por ejemplo, asistir a una reunión donde están consumiendo), puede generar lo que se conoce como recaída.
¿Y por qué pasa esto? Lo que ocurre es lo que se conoce como metaplasticidad. ¿Meta qué? Sería algo así como plasticidad de la plasticidad. ¿Sigue sonando confuso? Bien, como dijimos más arriba, el uso constante de una droga de abuso afecta la transmisión entre neuronas, y como consecuencia la forma en que se conectan entre ellas. Cuando el uso de la droga desaparece, durante el período de abstinencia, uno podría pensar que todo volvería a la situación de plasticidad previa al uso de la droga, pero no es así. Cuando la señal (la “tentación”) aparece, se activa una nueva plasticidad neuronal, diferente a la anterior al uso de la droga, y por eso se habla de plasticidad de la plasticidad, o metaplasticidad.
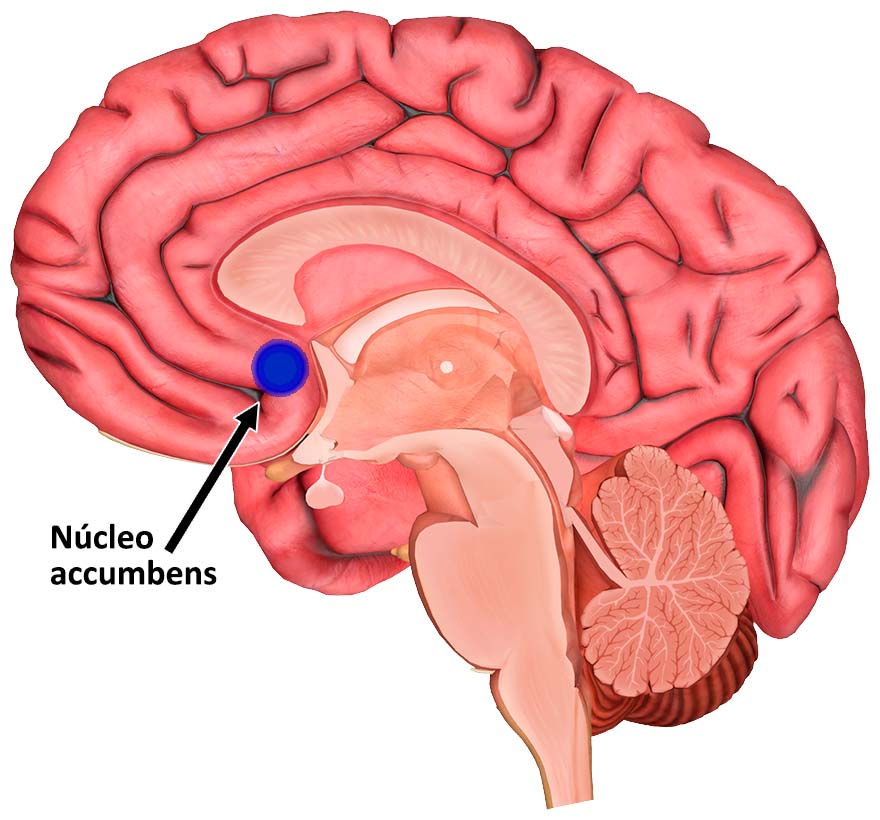
¿Y por qué se da este fenómeno? ¿Por qué nuestro cerebro no puede “reiniciarse” a su estado original? Según investigaciones del laboratorio del Dr. Kalivas, este proceso tiene lugar en una región muy particular de nuestro cerebro, el núcleo accumbens. Esta pequeña región se localiza en la parte frontal y bien adentro del encéfalo, y tiene un papel central en el procesamiento cognitivo de la aversión (o sea del rechazo o la repugnancia), la recompensa, el placer y, como se imaginarán, la adicción. Si bien muchas de las investigaciones sobre el efecto de las drogas de adicción, y también las que se utilizan en enfermedades mentales, se han centrado en las sinapsis (varios de los fármacos que se han desarrollado para este tipo de trastornos actúan sobre proteínas localizadas en esa región), en el laboratorio del Dr. Kalivas han ido un paso más allá para estudiar a otros dos protagonistas que participan en la conexión entre neuronas: la astroglia y la matriz extracelular.
La astroglia se encarga en gran parte del mantenimiento de la función neuronal, formando como una especie de red alrededor de las neuronas. La matriz extracelular es un tipo de “pegamento” formado por proteínas que no solo unen células entre sí, sino que participan también de manera activa en la comunicación entre ellas.
Como hemos señalado, en la zona de la sinapsis, aparte de estos últimos dos componentes mencionados, se encuentra el final del axón, que se conoce como presinapsis, y es a donde llega el impulso nervioso. Enfrente se encuentra la dendrita, que corresponde a la postsinapsis. Cuando el impulso nervioso llega al extremo del axón, se liberan compuestos conocidos como neurotransmisores, que viajan por el delgado espacio sináptico para llegar a la dendrita y reiniciar el impulso nervioso en la siguiente neurona.
Uno de estos neurotransmisores es el glutamato, que en caso de no ser utilizado en su totalidad por la dendrita es recaptado por proteínas transportadoras, que además de encontrarse en la presinapsis (terminal del axón) también se ubican en la astroglia, que en este caso cumpliría la función de evitar un “derrame” de glutamato hacia otras sinapsis cercanas.
Justamente, algunas drogas como la cocaína, el cannabis, la nicotina y la heroína producen una baja en el número de estos transportadores de glutamato en el núcleo accumbens, lo cual es en gran parte responsable de la mencionada metaplasticidad. Pero eso es solo un capítulo de este proceso. Cuando hay un período de abstinencia (que en animales de laboratorio implica aproximadamente tres semanas sin exposición a la droga de adicción), la astroglia se aleja de la presinapsis, dando lugar a una nueva conformación de la sinapsis, lo que finalmente se va a reflejar en una plasticidad diferente a la original (es decir, la que existía previamente a la exposición a la droga), la cual se expresará cuando aparezca una señal que indique la posible presencia de droga.

¿Qué ocurre ante este nuevo panorama estructural cuando aparece la señal que desata la recaída? El glutamato que se libera ante esa señal empieza a “derramarse” (la astroglia está más lejos de la presinapsis, y además hay menos transportadores en su superficie), lo que le permite activar a unas células cercanas llamadas interneuronas, que de esa manera comienzan a liberar a un neurotransmisor gaseoso, el óxido nítrico. En estas condiciones, este nuevo neurotransmisor actúa sobre una proteína de la matriz extracelular llamada metaloproteinasa 9 (MMP9), la cual a su vez es activada. ¿Y qué es lo que hace la MMP9? Comienza a degradar proteínas de la matriz, liberando fragmentos que son capaces de interactuar con componentes de la membrana de la región postsináptica, conocidas como integrinas, las cuales inician una serie de señales dentro de la dendrita que inducen su agrandamiento. Al extenderse la superficie de la dendrita, el número de receptores que captan el glutamato para iniciar el impulso nervioso en esa neurona va a ser mucho mayor, y por ende la respuesta va a ser más rápida y fuerte. Otro tipo de señales, que se dan en paralelo con lo que ocurre en la matriz extracelular, impulsan a la astroglia a acercarse nuevamente a la sinapsis, y todos estos procesos en conjunto terminan produciendo lo que se conoce como potenciación sináptica transiente, que es la que genera el accionar irrefrenable de búsqueda de droga que termina generando la recaída. Si, por ejemplo, la droga no aparece en un determinado período de tiempo luego de la señal, el sistema vuelve al estado de abstinencia, pero nunca regresa al estado original que existía antes del primer acceso a la droga.
¿Cómo inhibir la búsqueda de droga ante una señal? Como dijimos, por lo general muchos de los compuestos que hoy conocemos que regulan la comunicación entre neuronas apuntan a proteínas localizadas en los extremos pre y postsinápticos, pero ahora sabemos que podrían buscarse soluciones apuntando a los otros componentes que participan en la sinapsis, es decir la astroglia y la matriz extracelular.
Por ejemplo, se sabe que la N-acetilcisteína (precursor del aminoácido cisteína) sería capaz de reinstalar el transportador de glutamato que se ve disminuido en la superficie de la astroglia durante el período de abstinencia, evitando así el “derrame” de este neurotransmisor y la subsecuente síntesis de óxido nítrico ante una señal de presencia de droga, evitando así la recaída. De esta misma manera podría pensarse en buscar inhibidores de integrinas, de MMP9, o bloqueantes de receptores de glutamato o de la síntesis de óxido nítrico.
Conocer más en detalle el mecanismo a nivel molecular y celular que conduce a esta “plasticidad de la plasticidad” sin dudas nos abre nuevas puertas y nos ofrece posibles soluciones para que, en un futuro no tan lejano, las recaídas de aquellos que han logrado salir de la adicción a las drogas puedan ser evitadas, y de esta forma, como dice el título, no vuelvan a tropezar dos veces con la misma piedra.
Autor: Alberto Díaz Añel para la SAN
Photo by Mishal Ibrahim on Unsplash

